2018 年 12 月 21 日-22 日,由中国优生科学协会主办的 2018 围产医学论坛暨围产保健与优生学习班暨子痫前期标志物临床应用专题讨论会在北京圆满收官,本次大会由首都医科大学附属北京妇产医院张为远教授主持。北京大学第三医院杨孜教授对目前国内外子痫前期相关的指南和临床研究做了深刻的解读,深圳市妇幼保健院牛建民教授对于血清标记物在子痫前期临床管理中的医学价值做了精彩的报告,各位与会专家对子痫前期的相关问题展开了深入的学术讨论。

图1:首都医科大学附属北京妇产医院张为远教授
子痫前期 (Preeclampsia, PE) 是妊娠期特有的严重并发症之一,发生率约为所有妊娠的 3-5%,PE 可导致 15% 的早产和 42% 的孕妇死亡 [1]。子痫前期一经诊断,就要注意预防重度子痫前期和子痫的发生,避免包括重度高血压不可控制、高血压脑病和脑血管意外、子痫、心功能衰竭、肺水肿、完全性和部分性 HELLP 综合征、DIC、胎盘早剥和胎死宫内等在内的严重并发症。2015 年,我国妊娠期高血压疾病诊治指南 [2] 对 PE 的判定依据为:
妊娠 20 周后出现收缩压 ≥ 140 mmHg 和(或)舒张压 ≥ 90 mmHg,且伴有下列任一项:
尿蛋白量 ≥ 0.3 g/24 h
或尿蛋白量/肌酐值比值 ≥ 0.3
或随机尿蛋白检查阳性(仅用于无法进行尿蛋白量定量时)
尿蛋白检查阴性,但伴有以下任何一种器官或系统受累,如心、肺、肝、肾等重要器官,或血液、消化和神经系统的异常改变,或胎盘—胎儿受到累及等。
血压和(或)尿蛋白水平持续升高,发生母体器官功能受损或胎盘-胎儿并发症是子痫前期病情向重度发展的表现。

图2:深圳市妇幼保健院牛建民教授
子痫前期,临床诊疗决策十分棘手
据统计,约有 80% 疑似 PE 的孕妇并不会发展为 PE,造成很多孕妇被过度诊疗;与此同时,约有 38% 的子痫是突然发生的,患者之前并无高血压或蛋白尿的临床记录 [3]。血压和尿蛋白这两项指标对于预后的敏感性、特异性低,无法对 PE 做出及时、准确的风险预估。
进行母体-胎儿病情程度分析和个案评估是临床难点,需要医生对病情进行个案性地全面分析和评估。在临床上大体存在几种不同程度的重度子痫前期表现形式: 一种是单纯的血压或蛋白尿达到重度标准,伴或不伴胎儿生长受限;另一种是存在血压或蛋白尿以外其他系统或重要器官受到累及;还有一种是子痫前期伴发严重并发症 [2]。
如果是晚发子痫前期孕妇出现上述 3 种情形,做出适时终止妊娠的决策不难;但对于早发子痫前期孕妇,第一种情形是期待治疗可供选择的病例,第二种情形有必要在短时间严密监测下行促胎肺成熟后终止妊娠,而第三种情形的孕妇则需要在 24 小时内或 48 小时内尽快终止妊娠 [2]。
PE 危害诸多,产科医师该怎么办?
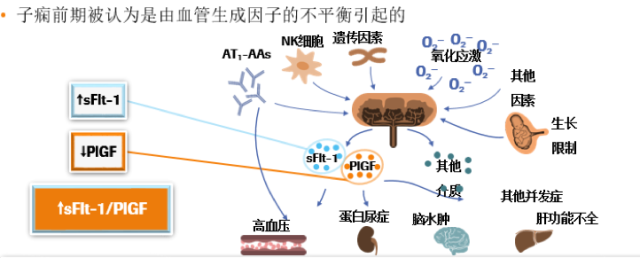
近年来,可溶性 FMS 样酪氨酸激酶-1(soluble FMS-like tyrosine kinase-1, sFlt-1)、胎盘生长因子(placental growth factor, PlGF)吸引了许多研究者的目光。2004 年《新英格兰杂志》发表文章首次提出增加的 sFlt-1 水平和降低的 PlGF 水平可以预测随后 PE 的发展 [4]。2018 年最新的一项研究提示:sFlt-1/PlGF 可做为诊断和预测 PE 的一项有效参数。sFlt-1/PlGF 的增加与临床需要分娩密切相关。sFlt-1/PlGF 适用于高风险子痫前期患者的密切监测,帮助临床决策。[5]

2016 年发表的 PROGNOSIS 研究 [3]——一项多中心、前瞻性、观察性研究共在全球 14 个国家招募了 1050 例疑似 PE 的孕妇,使用 sFlt-1/PlGF 比值来预测短期内是否会发生 PE。在包含 500 例受试者的队列中,研究者确定了 38 为截断值;之后,在包含 550 例受试者的验证队列中,研究者发现,可达到 99.3%(95% CI: 97.9% ~ 99.9%)的可靠性预测孕妇在一周内不会发生 PE,意味着孕妇可以安全回家;使用 sFlt-1/PlGF 比值>38 来预测 4 周内发生 PE 可能性的预测值为 36.7%(95% CI: 28.4% ~ 45.7%),其准确性约为现有检测方法的两倍,这些孕妇需特别注意,以确保及时治疗。本研究确定并验证了截断值评估 sFlt-1/PlGF 比例为 38,使用 Elecsys sFlt-1 和 PlGF 进行分析,可作为短期内有效预测排除单胎妊娠患者子痫前期的风险和临床疑似子痫前期患者。
sFlt-1/PlGF,近年来权威指南怎么说?

2016 年英国国家卫生与临床优化研究所 (NICE) 发布的 PE 相关指南 [6] 明确推荐使用基于 PlGF 水平的检测用于 PE 的临床管理:通过 Elecsys sFlt-1/PlGF(比值)电化学发光免疫分析法,结合临床评估及后续随访,帮助排除妊娠 20~34+6 周的疑似 PE 孕妇。sFlt-1/PlGF 比值的截断值和应用,检测平台具体的推荐如下(表 1):
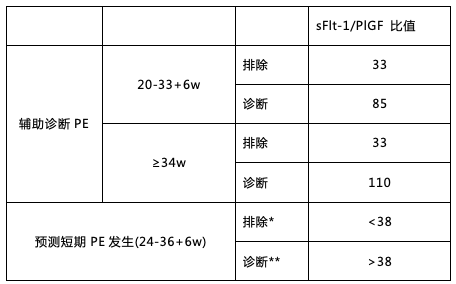
表 1 (*排除 1w 发生 PE **诊断 4w 发生 PE)
与此同时,2014 年德国「妊娠期高血压病的诊断与治疗」指南 [7] 推荐使用 sFlt-1/PlGF比值辅助诊断和短期预测 PE。指南提及:在妊娠早期筛查和妊娠中期筛查及预测中,从母体特征(年龄,体重,病史,种族)与一些生物物理指数(子宫动脉搏动指数,PAPP-A,PIGF)先行评估 PE 的个体风险,尤其是早发型 PE 的风险评估;而 sFlt-1 和 PlGF 的血清水平在 PE 出现临床表现前几周已经发生改变,使用 sFlt-1/PlGF 可确认或排除 PE 的怀疑,指南同时提出了 sFlt-1/PlGF 可做为住院治疗的适应症和 PE 患者稳定后的检测及预后评估。
2015 年国际妇产科超声学会于则发表了关于 sFlt-1/PlGF 比值用于单胎妊娠 PE 预测和诊断的解读 [6],sFlt1/PlGF 在胎盘相关疾病风险的患者中,(即 PE,HELLP 综合征,IUGR 和死产)已经凸显出其诊断和预测的医学价值,在最近的研究提及 sFlt-1 / PlGF 已成为管理 PE 的一个额外临床工具,其中指出:
sFlt-1/PlGF 比值<38:至少 1 周内不会发生 PE,且与孕期无关;
sFlt-1/PlGF 比值> 85(<34w)或> 110(≥ 34w):很可能发生 PE 或其他原因的胎盘功能不全,可结合临床 2-4 天复测;
sFlt-1/PlGF 比值 38-85(<34w)或 38-110(≥ 34w):这些女性暂不能诊断为 PE,但很可能在 4 周内发生 PE,可结合临床 1-2w 复测。
2018 年 3 月 1 日捷克ČGPS ČLS JEP 委员会批准了「妊娠期高血压疾病」推荐程序的修订版 [9],建议在妊娠 20 周至 36+6 周之间,对怀疑 PE 的女性检测 sFlt-1/PlGF 比值。此次修订提及在 PE 的亚临床阶段,PlGF 水平显着降低,sFlt-1 显着增加,通过对疾病亚临床阶段的识别能做到早期诊断,并从妊娠期高血压中区分出进展中的 PE,对与高血压和/或蛋白尿相关的疾病,例如肾,肝相关疾病和自身免疫疾病做鉴别诊断。
2018 年丹麦妇产科学会(DSOG)对现在的包括使用 sFlt-1/PlGF 比值作为 PE 诊断和治疗进行补充 [10],建议在妊娠 37 周之前怀疑 PE 的女性检测 sFlt-1/PlGF 比值,可用于改善和提高预测有迹象或症状的疑似诊断 PE 的患者。sFlt-1/PlGF 比值优于单独使用 PlGF 用于预测子痫前期和及其并发症。由于阴性预测值高,sFlt-1/PlGF 比值特别适用于排除有症状的 PE 患者。
2018 年最新公布的 ESC 妊娠期心血管疾病指南 [11]也提及:除需考虑基础实验室检测外,还可进行如下检查,若 sFlt1/PIGF 比值≦38,临床上可用于排除一周内临床怀疑子痫前期的发展。
2018 年 8 月同期,新西兰卫生部也公布了妊娠期高血压和子痫前期的诊断和治疗指南 [12],因为证据级别低,推荐级别为弱:PE 的发病机制是由于抗原调节因子与氧化应激标记物的不平衡所导致的内皮细胞功能障碍, 这一假说导致研究一些血清生物标记物以指导 PE 的诊断,例如:PIGF;sFlt-1;PAPP-A;PP-13 等。指南中列举了一项纳入 103 项观察性研究的系统评价(入组 432621 名孕妇)来评估血清标记物的准确性,虽然整体预测精确度低,但是表明了 PIGF 是最好的预测因子:PlGF 的截断值为 LR + 4.01(95%CI 3.74-4.28)和 LR-0.67(95%CI 0.64-0.69),汇总灵敏度为 0.56(95%CI 0.52-0.61),汇总特异度为 0.91(95%CI 0.89-0.92)[13]
同时在这一指南里,也提到了一个研究结论 [14]:
在妊娠早期(20-33 周),s-Flt-1:PlGF 比率 ≥ 85,灵敏度为 88%,特异性为 99.5%。
妊娠超过 20 周时,检测的敏感性为 76%,特异性为 95%。
妊娠晚期(≥34周),s-Flt-1:PlGF比率≥110的敏感性为58%,特异性为95%。
指南里的另一项研究 [15] 观察到 s-Flt-1/PlGF 比率也可用于预测有 PE 风险患者的不良妊娠结果(OR 9.5,95%CI 6.1-15,s-Flt-1/PlGF 比率> 39.2),女性低于妊娠 34 周(OR 47.8,95%CI 14.6-156.5)。该指南主推 PROGNOSIS 研究的结论。s-Flt-1/PlGF 比率测定的进展为 PE 的预测性测试带来了希望。适合临床使用。需要更多证据来确定临床实践中是否使用 s-Flt-1/PlGF 比率来有效识别有 PE 风险并带来阳性结局的患者。
此外,在 2018 年 10 月 10 日发布了新的「ISUOG 实践指南:超声在子痫前期的筛查和随访中的作用」[16]:建议在孕 11-13 周时,联合母体因素,母体动脉血压,子宫动脉血流和 PlGF 水平,似乎是鉴定有 PE 风险的孕妇最有效的筛查模型(B 级推荐)。
截至 2018 年 4 月,PubMed 发表了 400 篇文章关于联合筛查这一热门的产科主题,多个研究表明:平均动脉压升高,母体 AFP 和 sFlt-1 浓度高,低浓度的 PlGF 和 PAPP-A 以及子宫动脉阻力指数增高,往往提示产妇发展成为 PE 风险增加。这些研究结论与 ASPRE 研究结论相符。而在孕晚期,PlGF 结合 sFlt-1 能分别预测 83% 的孕 37 周前和 38% 的孕 37 周后 PE 的发生。sFlt-1/PlGF 比值做为独立的标志物能预测超过 75% 在 4 周内发展成为 PE 的病例,且在孕 31-34 周的敏感性显著高于孕 35-37 周(假阳性率分别为 1.7% 对比 9.6%)[17]

图3:研讨会合影
对于子痫前期筛查,诊断,预测、预防及监测和诊治仍任重而道远。
参考文献
1. Am J Obstet Gynecol. 2010 Feb;202(2):161.e1-161.e11.
2. 中华妇产科杂志, 2015, 50(10): 721-728.
3. N Engl J Med. 2016 Jan 7;374(1):13-22.
4. N Engl J Med 2004; 350:672-83
5. Archives of Gynecology and Obstetrics (2018) 298:567–577
6. NICE. PlGF-based testing to help diagnose suspected pre-eclampsia (Triage PlGF test, Elecsys immunoassay sFlt-1/PlGF ratio, DELFIA Xpress PlGF 1-2-3 test, and BRAHMS sFlt-1 Kryptor/BRAHMS PlGF plus Kryptor PE ratio) [EB/OL]. [2017-10-15]
7. Hypertensive Schwangerschaftserkrankungen: Diagnostik und Therapie; updated 2014
8. Ultrasound Obstet Gynecol 2015; 45: 241–246
9. Hypertensive diseases in pregnancy, Recommended Procedures of the Czech Gynecological and Obstetrical Society and the J.E. Purkyně Czech Medical Association. Čes. Gynek. 2018;83:145–54
10. Dansk Selskab for Obstetrik og Gynækologi Guidelines 2018
11. European Heart Journal (2018) 00, 1–83
12. Ministry of Health. 2018. Diagnosis and Treatment of Hypertension and Pre-eclampsia in Pregnancy in New Zealand: A clincial practice guideline.
13. Zhong Y, Zhu F, Ding Y. 2015. Serum screening in first trimester to predict pre-eclampsia, small for gestational age and preterm delivery: systematic review and meta-analysis. BMC Pregnancy and Childbirth 15: 191
14. Verlohren S, Herraiz I, Lapaire O, et al. 2014. New gestational phase-specific cutoff values for the use ofthe soluble fms-like tyrosine kinase-1/placental growth factor ratio as a diagnostic test for preeclampsia.Hypertension 63(2): 346–52.
15. Rana S, Powe CE, Salahuddin S, et al. 2012. Angiogenic factors and the risk of adverse outcomes in womenwith suspected preeclampsia. Circulation 125(7): 911–9.
16. Clinical standards committee. ISUOG Practice Guidelines: role of ultrasound in screening for and follow-up of pre-eclampsia. Ultrasound Obstet Gynecol 2018.
17. Dragan I, Wright D, Fiolna M, Leipold G, Nicolaides KH. Development ofpre-eclampsia within 4 weeks of sFlt-1/PlGF ratio > 38: comparison of performanceat 31–34 vs 35–37 weeks』gestation. Ultrasound Obstet Gynecol 2017; 49:209–212
