妊娠期间和产后发生急性肾损伤(AKI)的病因在诊断方面具有挑战性,因为医生必须考虑许多普通人群之外的病因,如先兆子痫、子痫、HELLP 综合征(子痫、溶血、肝酶升高和低血小板)以及血栓性微血管病(TMAs)等。Kidney International 杂志近期在 Teaching Cases 版块刊登了一个妊娠相关的非典型溶血尿毒综合征(aHUS)病例,回顾了与之相鉴别诊断的临床情况,如先兆子痫、子痫等的临床表现和病理生理机制,聚焦于诊断的挑战性方面,还回顾了依库珠单抗的临床应用情况。
病例介绍
一位 23 岁的女性,在怀孕 38 周时需要行剖宫产来治疗重度先兆子痫和臀外露。她是第一次怀孕,不吸烟,无已知的先兆子痫家族史。她从外院出院,口服拉贝洛尔治疗,2 周后在家发作一次癫痫。再次回到外院时,收缩压>180 mmHg,接受了静脉劳拉西泮和镁剂(负荷剂量 6 g,以 2 g/h 速度静滴)治疗。之后患者被转入我院接受进一步的治疗。
转入我院后,患者无法回忆起她的癫痫发作情况,并述视觉模糊,感觉「雾蒙蒙」。血压 160/120 mmHg,心跳 110 次/分(窦速)。体检发现的阳性体征包括:深部肌腱反射显著减弱和执行命令缓慢。脐下可触及子宫底部,下肢有微小的指压性水肿。
实验室检查:血清肌酐 Scr 水平(1.3 mg/dl)显著升高,肝功能正常,轻度贫血,不伴血小板减少,乳酸脱氢酶 LDH 水平>2000 U/L。没有患者基线 Scr 的数据。脑部 MRI 显示:在双侧后顶叶、枕叶和颞叶处 T2/FLAIR 信号增强、深灰色核和脑室周围白质与后部可逆性脑病综合征(图 1)。
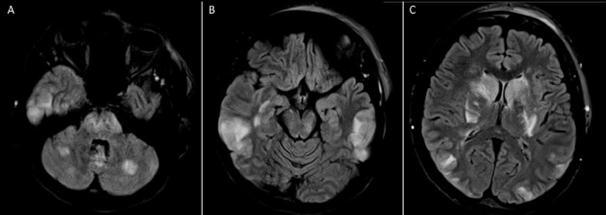
图 1 脑部 MRI 图像显示小脑部位(A)、双侧后顶叶(B)和脑室周围白质(C)T2/FLAIR 信号增强,与后部可逆性脑病综合征一致。
诊断为严重的先兆子痫。产科团队使用尼卡地平输注治疗患者的高血压,静注晶体液治疗患者的 AKI。患者持续静滴镁剂 24 h,之后逐渐剂量滴定至血镁浓度 4~6 mg/dL(3.3~4.9mEq/L)。患者的 Scr 水平持续恶化,在入院后的第 5 天,Scr 水平升至 2 mg/dl。
请肾内科会诊,进行了进一步的检查。尿液分析显示蛋白尿定量 2.4 g/d,血尿 3+,尿液显微镜镜检显示非变形红细胞。外周血涂片显示 2~3 个破碎红细胞/HP。血清学检查显示 ADAMTS13 活性 40%,补体水平正常。子宫超声未见受孕的滞留产物。
除了支持性治疗,患者的肾功能继续恶化,遂进行了肾活检。光镜显示 TMA 伴入球小动脉血栓形成。显著的内皮水肿和粘液内膜增生导致小动脉近闭塞性狭窄。肾小球缺血、内皮细胞肿胀、伴内皮下絮状物沉积,基底膜双轨征形成。没有毛细血管增生(图 2)。免疫荧光未见免疫复合物(IgG)或 C3 沉积。毛细血管壁有 IgM 和 IgA 非特异性染色。电镜显示缺血性改变,未见免疫复合物。
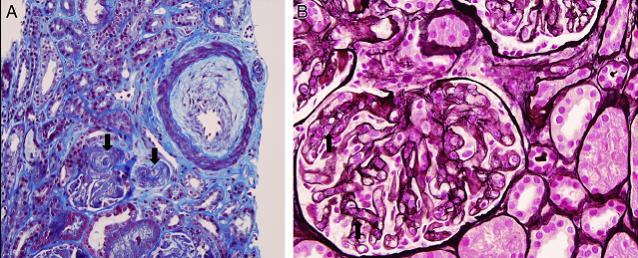
图 2 肾活检光镜结果(A)入球小动脉血栓形成(箭头处),内皮水肿伴粘液内膜增生导致小动脉管腔严重狭窄。(B)系膜溶解(黑箭头)和基底膜双轨征(线性箭头)反应了肾小球的缺血性损伤。
对补体介导的 HUS 相关的多种基因(包括 CFH、CD46、CFI、C3、CFG、CFHR1、CFHR3、CFHR4、CFHR5、THBD、PLG 和 DGKE)进行了突变检测,共发现了 3 个突变。第一个是 C3 第 17 号外显子的杂合错义变体。第一个是 CFH 第 17 号外显子的杂合内含子变异体。第三个是 CFI 第 11 号外显子的杂合内含子变异体。
诊断:产后非典型溶血尿毒综合征,可能与 C3、CFH 或 CFI 的突变有关
临床随访
肾活检结果回报后立即开始对患者进行血浆置换治疗。肾功能持续恶化,遂予以依库珠单抗 900 mg 每周静滴一次,连续 4 次。在住院的第 17 天,她依然需要透析。起病 4 个月后,Scr 水平有所改善,她不再需要透析。写这篇文章时又过去了 4 个月,她目前接受依库珠单抗 1200 mg,每 2 周静滴一次。
病例讨论
我们报道了一例产后妊娠相关性 TMA 的病例。该年轻女性之前从未有过血小板减少,并且在补体瀑布中检测到 3 个临床意义未明的基因突变。产后 AKI 病因的诊断尤其具有挑战性,除了需要考虑 AKI 的常见病因(如肾脏灌注不足和急性肾小管坏死)之外,还需要考虑先兆子痫、子痫、HELLP 综合征、TTP 和 aHUS。这五个病因很难鉴别,虽然发病机制各异,但这些疾病都有内皮损伤参与,并且都可表现为血管内溶血、血栓性血小板减少症和肾功能衰竭。
先兆子痫是指妊娠 20 周后新发的高血压、蛋白尿和水肿。有些患者临床表现严重,包括严重的高血压、视觉障碍、血小板减少症、微血管病性溶血性贫血。先兆子痫是由于胎盘产生的循环抗血管生成因子的水平增加而导致的。循环抗血管生成因子通过阻止血管内皮生长因子与其内源性受体相结合,可引起内皮细胞功能不全、高血压和蛋白尿。先兆子痫患者的肾活检结果典型的表现即是严重的内皮细胞肿胀。子痫是指先兆子痫的患者发生癫痫发作。而 HELLP 综合征常常被认为是一种更加严重的先兆子痫(虽然还存有争议)。
原发性 TMA 可由 TTP 或 HUS 导致,经典的临床表现是微血管病性溶血性贫血、血小板减少和由于毛细血管血栓形成引起的 AKI 以及内皮损伤。TTP 是由于先天遗传性或后天获得性 ADAMTS13 缺陷所导致。ADAMTS13 缺乏或活性受损将导致大的 vWF 多聚体形成,增加微血栓形成的倾向。aHUS 有多种不同的分类方法。由于研究人员确定了致病性补体突变导致补体系统替代途径不受控制的激活,aHUS 的概念在不断演变,现在广泛称为补体介导的 HUS。HUS 也可以由非补体因素介导,即已知的继发性 HUS,包括 Shiga 毒素和抗血管生存药物。
由于所有的病因都可表现为肾衰竭,血小板减少和微血管病性溶血性贫血,因此搞清楚上述不同疾病的临床特征之间的区别就显得很重要,尤其是在妊娠或产后的患者中。先兆子痫、子痫和 HELLP 综合征应该随着胎盘的娩出而病情改善,虽然有些患者可能症状持续至产后 4~6 周。该患者可能有 TMA 的第一个迹象是尽管分娩结束,但临床病情却还在恶化。此外,TTP 倾向于发生在妊娠的第二或第三个阶段,通常导致更为严重的血小板减少,而肾功能衰竭表现较 aHUS 轻。aHUS 更多的发生在产后。
尽管本病例缺乏血小板减少这一显著的特点,但是经典的溶血三联征、血小板减少症和肾衰竭并不一定在所有 TMA 患者中都出现。队列研究已经证实 13%~44% 经活检证实的各种病因导致的 TMA 患者没有血小板减少症,19% 产后发生的补体介导的 HUS 患者没有血小板减少症。因此,临床医生不能依赖经典的血管内溶血三联征、血小板减少症和肾衰竭来检测所有的 TMA 病例。不伴血小板减少的 TMA 通常被诊断为其它病因,预后更差。建议临床医生要保持高度怀疑,尤其是在已知补体激活的情况下,如妊娠和感染。
对疑似 TMA 的围产期患者的初步评估,推荐外周血涂片检测破碎红细胞,并检测补体和 ADAMTS13 的水平。低 ADAMTS13 活性(<5%)满足 TTP 的诊断条件。如果血小板减少不妨碍的话,应该进行肾活检。如果 ADAMTS13 活性正常,而且肾活检也发现 TMA,在产后的背景下需要强烈考虑 aHUS。
遗憾的是,对于 aHUS 并没有明确的诊断标准。虽然补体的基因检测有时候仍然难以获得,并且需要数周的时间回报结果,但 HUS 中致病性补体突变的发现革新了我们对 HUS 发病机制的认知。此外,50% 的 HUS 患者没有已知的致病性补体突变,如本例中的患者。补体突变,如那些影响 CFH 或 MCP 的补体突变,常常在儿童中自发性出现,但是许多补体突变的患者并不表现出补体介导的 HUS 的征象,直到经历了补体激活事件(如感染或妊娠)才表现出来。
妊娠因激活补体系统而臭名昭著。一项队列研究发现 21% 的 HUS 女性有与妊娠有关的表现,这其中 79% 发生在产后阶段。这可能是因为胎儿细胞在妊娠期间进入母体循环产生抗体,激活了补体替代途径,在有遗传易感性的患者中导致 aHUS;或者可能是因为胎盘本身通过膜结合蛋白衰减加速因子改变了对补体瀑布的调节。
本例中的患者 C3 序列的变异在一般人群中比较少见,之前曾在 aHUS 的患者中报道过 2 次。一次是在一个已知补体介导的 HUS 的家族中,虽然这些受影响的家庭成员同样还携带之前报道过的 MCP 突变。另一项报道的一位 aHUS 患者有 C3 序列的变异,但是作者没有进行功能性意义的检测。另两项关于 CFH 和 CFI 的序列变异之前没有报道。所有这些突变的临床意义未明。
这个病例的精确诊断很困难,因为对于补体介导的 TMA 没有明确的诊断标准,而且该患者补体系统的序列变异还不清楚是否有功能。该病例支持补体介导的 TMA 的特征包括:患者有补体突变,并且在接受依库珠单抗治疗后病情有改善。此外,在分娩后 5 周病情仍持续恶化也不是先兆子痫的典型表现。但是,该患者有几个特征支持子痫,包括严重的高血压、微血管病性溶血性贫血以及这是她的首次妊娠。
该病例提示我们,对于补体介导的 TMA 需要更精准的标准,以便临床医生能够快速识别哪些患者最有可能受益于依库珠单抗(一种 C5 膜攻击复合物抑制剂)。证实依库珠单抗在 aHUS 中获益的研究在入组时排除了补体基因突变的患者。依库珠单抗治疗很昂贵,所以准确地识别哪些患者能从中受益很重要。
虽然诊断具有挑战性,但是迅速治疗却很重要,延误治疗与较差的肾脏结局和患者预后有关。如果怀疑 TTP 或 aHUS,必须立即送检化验并启动血浆置换治疗。如果最终诊断为补体介导的 HUS,应该开始依库珠单抗治疗。但是指导依库珠单抗治疗的随机对照试验的数据很少。
总之,产后 AKI 的病因诊断具有挑战性,医生尤其需要考虑到 TMA 的可能性。TMA 的临床特点与严重的先兆子痫和子痫有些相似之处,后两者在妊娠晚期和产后更多见。重要的是,血小板减少并不一定在所有 TMA 中都出现。如果临床医生认为患者是 aHUS,应该进行补体突变的基因检测。除了对患者的长期治疗及其重要之外,基因检测还能发现新的相关突变。
Teaching Points
1. 妊娠可以暴露出机体对 aHUS 潜在的易感性。
2.HUS 可以不表现为显著的血小板减少,这使得诊断具有挑战性。
3. 产后阶段出现难以解释的 AKI 应该进行肾活检。
4. 对产后背景下诊断为 aHUS 的患者应该进行基因检测,以识别补体系统中可能导致 TMA 的基因突变。
