慢性肾脏病(CKD)是我国常见的重大慢性疾病之一,发病率高,危害大。很多常见的 CKD 好发于育龄期妇女,处理不好将对母婴健康带来危害。加之目前我国「二胎」政策的普及,上述问题更加突显,亟需制定相关的临床实践指南,规范诊疗,为医护人员提供指导,为病人教育提供素材,推动 CKD 妊娠的诊治和管理水平以及相关性临床研究的开展。
有鉴于此,由南京总医院,国家肾脏疾病临床研究中心的刘志红院士牵头,联合我国肾脏病和妇产科领域的专家(名单附后),共同撰写制定了《慢性肾脏病患者妊娠管理指南》。该指南已发表在《中华医学杂志》(2017 年第 97 卷第 46 期)。现将指南内容汇总如下,与大家分享。
CKD 患者妊娠风险评估
1. 妊娠期肾脏的生理变化
为了适应胎儿发育和孕妇健康的需要,妊娠期肾脏会发生一系列生理性变化:
肾脏体积会增大
肾小球和肾小管功能发生变化
肾血流量和肾小球滤过率(GFR)显著增加,至妊娠中期达到高峰(增加 50% 以上),使体内的代谢产物排出增加,血清肌酐(SCr)、尿素氮和尿酸的水平会略低于非妊娠期
妊娠期女性的 SCr 水平,即使还在正常范围内,可能已经出现了肾脏损害。研究显示妊娠中期估算 GFR (estimated GFR,eGFR) 水平与妊娠不良事件呈 U 形曲线,eGFR 120~150 ml·min-1·(1.73 ㎡)-1 孕妇妊娠预后最好,而 eGFR 过高或过低预后均较差。
肾功能评估
CKD 的诊断标准为肾脏损害和(或)GFR 下降至<60 ml/min,持续 3 个月。肾脏损害是指肾脏结构或功能异常,出现血液、尿液成分和影像学异常,肾组织出现病理形态学改变。GFR 是评价肾功能的最好指标,因此,根据 GFR 水平将 CKD 分为 5 期。
CKD 1 期:GFR ≥ 90 ml/min
CKD 2 期:60~89 ml/min
CKD 3a 期:GFR 30~44 ml/min
CKD 3b 期:GFR 45~59 ml/min
CKD 4 期:GFR 15~29 ml/min
CKD 5 期:GFR <15 ml/min 或维持性透析
GFR 可以通过一些预测公式来估算,改善全球肾脏病预后组织 (Kidney Disease: Improving Global Outcomes, KDIGO)2012 年推荐使用基于 SCr 的 GFR 估算公式,目前临床常用的是 MDRD 或慢性肾脏病学流行病学合作研究(CKD-EPI)公式。CKD 的定义及分期直到近几年才逐渐引入产科肾脏病学(Obstetric nephrology)。鉴于妊娠期肾脏生理的变化,CKD 分期标准只适用于患者妊娠前的基础肾功能评估。
肾脏疾病病情评估
CKD 患者的肾功能状况(CKD 分期)、是否合并高血压和蛋白尿较 CKD 病因对妊娠结局的影响更大,血压越难控制、CKD 越晚期的患者妊娠,发生不良妊娠结局的风险越大。而在 CKD 病因中,狼疮性肾炎(LN)和糖尿病肾病等系统性疾病的影响最为显著。
CKD 分期
肾功能是影响妊娠结局的关键因素。随着 CKD 的进展,肾功能损害加重的风险 (CKD 进展或开始透析)、新发高血压、蛋白尿新发或倍增,剖宫产、早产、小胎龄儿(small for gestational age infant,SGA)和新生儿入住重症监护(NICU)率均逐步升高。即使是 CKD 1 期也是早产、SGA 和 NICU 治疗等不良妊娠结局的独立危险因素。
高血压
CKD 患者高血压发生率较普通人群明显升高,CKD 患者妊娠后高血压发生率进一步增加,CKD 1 期患者新发高血压率约 7.9%,而 CKD 4-5 期新发高血压率高达 50%。CKD 合并高血压患者并发先兆子痫(PE)、肾功能恶化、死胎,FGR 及早产率较 CKD 同期血压正常者明显增高。若血压不易控制或需要多种降压药物才可控制时,PE 的发生率进一步增加。
蛋白尿
大量蛋白尿是 CKD 进展的独立危险因素,但与高血压和 CKD 分期相比,蛋白尿对妊娠结局的影响最小。CKD 患者妊娠可加重蛋白尿,CKD 1 期约 20% 的患者出现蛋白尿倍增,而 CKD 3 期以上蛋白尿倍增者高达 70%~80%。大量蛋白尿导致母体低蛋白血症,可引起 FGR;同时血浆白蛋白下降可减少子宫胎盘血流,胎盘灌注不良,胎儿氧和营养物质供应不足,造成胎儿处于长期慢性缺氧状态,从而引发 FGR、新生儿窒息、甚至胎死宫内等情况。此外,肾病综合征会进一步加重孕妇高凝状态。
因此,CKD 早期(CKD 1~2 期)孕妇,仅有轻微肾脏损害,妊娠前肾功能正常,血压正常,无或微量蛋白尿时,肾脏损害进展风险低,妊娠结局较好,但是妊娠并发症仍高于普通人群。CKD 中晚期(CKD 3~5 期)患者妊娠出现肾功能下降和不良妊娠结局的风险明显升高。
CKD 患者妊娠时机
鉴于以上对 CKD 患者妊娠风险评估,推荐 CKD 早期血压控制正常、尿蛋白定量<1 g/24 h 的患者可考虑妊娠,但仍需认识到妊娠的风险。
以下 CKD 患者不推荐妊娠:
CKD 3~5 期患者
高血压难以控制的患者,建议暂缓妊娠,直至血压控制正常后
伴有蛋白尿的患者,建议暂缓妊娠,直至治疗控制尿蛋白定量<1 g/24 h 至少 6 个月
活动性 LN 增加肾病复发、早产和 PE 的风险,不推荐妊娠,建议暂缓妊娠,直至疾病治疗达完全缓解状态或病情稳定接近完全缓解状态至少 6 个月
伴中重度肾功能损害的糖尿病肾病患者妊娠后出现不可逆肾功能下降及进展到肾病范围蛋白尿风险高,不推荐妊娠
LN 和糖尿病肾病等系统性疾病的肾外疾病不适合妊娠的评估见相关指南
以上情况 CKD 患者如仍有强烈妊娠意愿,需要肾脏病医师和高危妊娠产科医师的密切随访及 NICU 支持治疗。
鉴于透析患者的生育能力下降,强化透析需每周透析时间增加到>36 h,才能提高胎儿的活产率,且即使强化透析患者妊娠风险仍然很高。出现病理妊娠后,药物或手术终止妊娠时孕妇大出血等风险明显增加。同时由于国内透析条件的限制,因此,不推荐血液透析和腹膜透析患者妊娠。
肾移植受者在医师的指导下,依据病情及治疗情况,择期妊娠。大部分肾移植孕妇较非妊娠患者远期移植肾功能无显著差异,但不良妊娠结局的风险较健康人群高。胎儿丢失率、PE 及感染发生率高,尤其是妊娠前 SCr>150 μmol/L,伴高血压和糖尿病的患者。妊娠期移植排斥反应总体发生率仅为 4.2%。肾移植受者如有生育意愿,移植后需要一段稳定的时间,调整药物至妊娠相对安全的抗移植排斥方案,且不影响移植肾功能,降低妊娠期急性排斥的风险。欧洲最佳实践指南推荐延迟到移植后 24 个月妊娠。
美国移植学会推荐移植后至少 1 年妊娠,并满足以下标准:1 年内无移植排斥反应;肾功能良好且稳定(SCr< 133 μmol/L);无或微量蛋白尿;无致胎儿毒性的急性感染;稳定且无致畸作用的抗移植排斥药物。
CKD 患者妊娠管理
为使 CKD 孕妇获得更好的结局,需要多学科共同支持,加强 CKD 妊娠管理,包括妊娠前管理、妊娠期管理、分娩期管理和产后管理,强调 CKD 原发疾病和高血压的控制及相关并发症的处理,其中 PE 的预防、诊断和治疗参见妊娠期高血压疾病诊治指南。
1. 妊娠前管理
推荐 CKD 女性患者在尝试受孕前 3~6 个月采用妊娠期安全的免疫抑制剂获得疾病的缓解;疾病缓解前要严格避孕,避孕措施只推荐含孕激素的制剂;对于育龄期女性,尽量避免使用对生育能力有影响的药物。
避孕
所有 CKD 女性患者在疾病缓解前均要严格避孕。
避孕措施只推荐含孕激素的制剂,包括只含孕酮的片剂、肌内注射剂和宫内节育装置。
而含雌激素的制剂,有增加血栓发生和加重高血压的风险,因此伴高血压、血管疾病、大量蛋白尿或吸烟的女性都应避免使用,尤其是患有血管疾病者禁用。
工具避孕不可靠,不推荐作为唯一的避孕方法。
生育能力
原发疾病和治疗药物都影响患者的生育能力。肾功能损害加重,体内激素水平异常,不孕率增加;药物不良反应、疲劳、抑郁症和使用免疫抑制剂都可导致性功能障碍,生育能力下降。
环磷酰胺直接造成卵巢损伤,口服给药较静脉给药对闭经的影响更持久,因此建议静脉给药,并谨慎选择使用剂量和疗程。尽量避免在育龄期女性使用环磷酰胺,可选择其他合适的药物如吗替麦考酚酯、钙调蛋白抑制剂、硫唑嘌呤和利妥昔单抗治疗 LN、肾病综合征和血管炎等免疫性肾小球疾病。
辅助生殖技术有增加 CKD 女性妊娠的可能性,但目前尚无研究来指导临床实践。
疾病优化管理
任何活动性肾脏疾病都有可能导致不良妊娠结局,推荐至少在尝试受孕前 3~6 个月采用妊娠期安全的免疫抑制剂以获得疾病缓解。
对无需使用免疫抑制剂的患者,肾素血管紧张素系统(RAS)抑制剂是主要的减少蛋白尿的药物,推荐 RAS 抑制剂使用直至尝试受孕。
2. 妊娠期管理
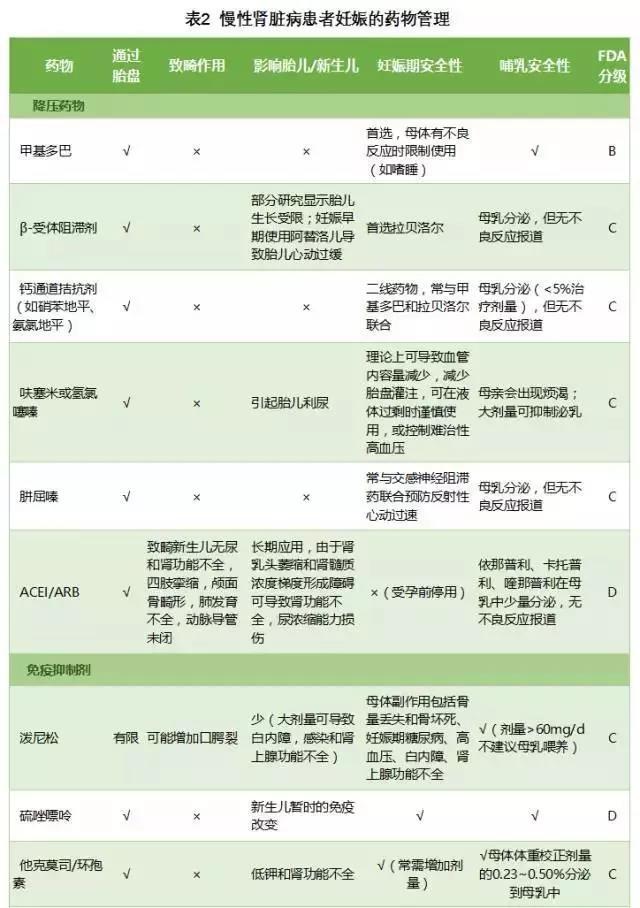
CKD 患者的妊娠期管理包括血压管理、药物管理、实验室检查、胎儿监测及分娩期注意事项(表 1),肾脏科医师应重点关注妊娠期药物管理(表 2),尤其是免疫抑制剂的使用和血压的控制。
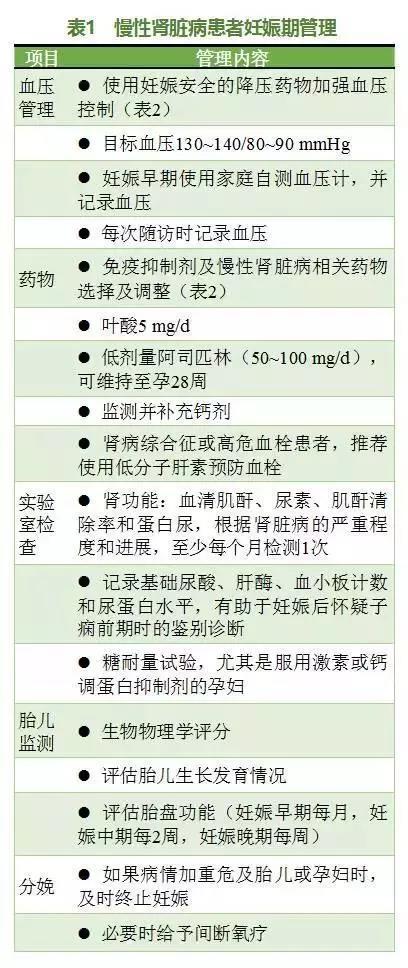
免疫抑制剂
推荐的妊娠期安全使用的免疫抑制剂包括糖皮质激素、羟氯喹、硫唑嘌呤和钙调蛋白抑制剂,利妥昔单抗仅作为妊娠早期治疗的最后手段,但都仅在可能的利益大于对胎儿潜在的危险时使用。环磷酰胺、吗替麦考酚酯、来氟米特和甲氨喋呤有致畸作用,妊娠期禁忌使用,应至少在受孕前 3~6 个月停用(表 2)。
糖皮质激素:妊娠期应根据肾脏病情况,尽可能减少糖皮质激素的剂量,推荐同非妊娠患者,在疾病严重活动时,也可以使用大剂量甲泼尼龙冲击治疗。糖皮质激素可以选择泼尼松或泼尼松龙,不建议使用含氟的激素,只有在妊娠晚期促胎肺成熟时才使用含氟的糖皮质激素如地塞米松或倍他米松。仅约母体剂量 10% 的泼尼松可通过胎盘进入胎儿体内,因此泼尼松总体对胎儿是安全的,但大剂量泼尼松可能与胎膜早破相关。糖皮质激素其他的副作用与非妊娠患者相似,包括妊娠期糖尿病、体重增加、高血压、骨质疏松、白内障、感染和情绪变化的风险增加。
羟氯喹:羟氯喹无致畸形作用。妊娠期应继续或开始使用以维持肾脏疾病缓解或控制肾外狼疮活动,停用羟氯喹,会导致妊娠期狼疮复发的风险增加。
硫唑嘌呤:硫唑嘌呤是妊娠期常用的维持疾病缓解药物。动物实验报道硫唑嘌呤有致畸作用,但因人类胎儿肝脏缺乏将硫唑嘌呤代谢为活化产物 6-巯基嘌呤的次黄嘌呤核苷酸焦磷酸化酶,因此不会导致胎儿畸形。肾移植受者在妊娠期间给予硫唑嘌呤治疗后,新生儿先天畸形率与一般人群无差异,也说明硫唑嘌呤无致畸作用。
钙调蛋白抑制剂:移植受者的研究显示钙调蛋白抑制剂(如环孢素或他克莫司)不增加致畸风险,妊娠期可以安全使用。妊娠期由于环孢素和他克莫司分布容积的变化及肝脏代谢增加,自妊娠中期开始,药物剂量需逐渐增加至妊娠前的 20%~25%。同时为减少药物的副作用,注意个体差异,使用有效的最低剂量,为降低潜在的药物毒性,需谨慎滴定药物浓度,维持药物浓度在低治疗窗,且需在产后快速减量至妊娠前剂量。
环磷酰胺和吗替麦考酚酯:环磷酰胺和吗替麦考酚酯有致畸作用,妊娠期间避免使用。妊娠早期应用环磷酰胺,会导致胎儿颅盖骨、耳和头面部结构、肢体和内脏器官异常及发育迟缓,妊娠晚期应用会导致 FGR、造血抑制和神经损伤。妊娠早期应用吗替麦考酚酯,流产率高,且会导致胎儿发生较大的先天缺陷,包括唇腭裂、小耳畸形伴外耳道闭锁和小颌畸形等。
利妥昔单抗:利妥昔单抗可通过胎盘,导致新生儿发生 B 细胞耗竭,自妊娠中期至足月,发生率和严重程度逐渐增加。因此,建议利妥昔单抗仅作为妊娠早期治疗的最后手段,但是胎儿宫内暴露于利妥昔单抗对免疫系统发育的影响尚不确定。推荐母体曾使用利妥昔单抗的新生儿,在常规疫苗接种前应监测 B 细胞,必要时延迟疫苗接种。
降压治疗
妊娠期目标血压 130-140/80-90 mmHg(1 mmHg = 0.133 kPa),避免过度降压导致胎盘灌注不足而影响胎儿生长发育。妊娠期安全的降压药物包括甲基多巴、拉贝洛尔和长效硝苯地平。
1. 降压目标:建议谨慎维持妊娠期血压 130~140/80~90 mmHg,注意血压平稳下降,降压幅度不能太大,以平均动脉压(MAP)的 10%~25% 为宜,争取 24~48 h 达到稳定,避免过度降压导致胎盘灌注不足而影响胎儿生长发育。妊娠期高血压 CHIPS 研究显示强化降压(目标舒张压 85 mmHg)和非强化降压(目标舒张压 100 mmHg)两组终点事件(妊娠失败或高标准 NICU>48 h)发生率分别为 31.4% 和 30.7%,差异无统计学意义,两组低体重儿和围产儿死亡率也无差异。但是值得关注的非强化降压组发生重度高血压(>160/110 mmHg)较强化降压组更常见(40.6% 和 27.5%,P<0.001),这可能会加重潜在的肾脏疾病。该研究也证实妊娠期 130~140/80~90 mmHg 目标血压的安全性。
2. 降压药物:妊娠期安全的降压药物包括甲基多巴、拉贝洛尔和长效硝苯地平。研究显示甲基多巴较拉贝洛尔降压治疗组,围产儿和孕妇不良结局发生更少,包括 SGA、早产、严重高血压、PE、婴儿呼吸窘迫综合征、脓毒症和癫痫等,提示甲基多巴较拉贝洛尔对高血压孕妇更有益。
其他β-受体阻滞剂(如美托洛尔)和钙通道阻滞剂(如尼莫地平和尼卡地平)仅在孕妇不能耐受上述推荐更安全的降压药时替代使用。
利尿剂可导致血液浓缩、有效循环血量减少和高凝倾向,因此仅当孕妇出现全身水肿、肺水肿、脑水肿、肾功能不全、急性心功能衰竭等情况时,才可酌情使用呋塞米等快速利尿剂。螺内酯可通过胎盘,对胎儿产生抗雄性激素作用,妊娠期应避免应用。
RAS 抑制剂可导致心脏和肾脏缺陷,包括房间隔缺损、室间隔缺损、肺动脉瓣狭窄、动脉导管未闭和肾发育不全,及羊水过少的相关并发症(肢体挛缩、肺发育不全和颅面骨畸形),因此妊娠期绝对禁止使用。
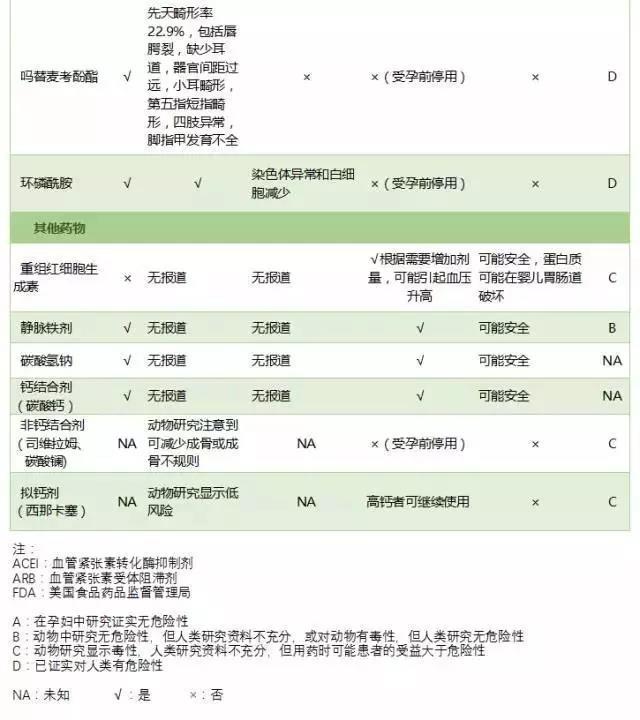
其他 CKD 患者常用药物
中晚期 CKD 孕妇可能面临包括贫血、酸中毒、高磷血症和骨病等并发症。
妊娠期促红细胞生成素(EPO)相对缺乏,同时存在妊娠相关的炎症因子导致 EPO 抵抗,CKD 孕妇可发生严重贫血,影响胎盘和胎儿的生长。建议维持 CKD 孕妇血红蛋白 100 g/L,使用 EPO 及口服铁剂纠正贫血是安全的,通常剂量需要增加,但静脉铁剂是妊娠期 B 类用药。
妊娠期女性血 pH 值偏碱性,除非出现严重酸中毒,CKD 孕妇一般不需要补充碳酸氢盐。
关于治疗钙磷平衡及继发甲状腺功能亢进症常用药物的妊娠安全性研究有限,均定为 C 类。妊娠期可以用碳酸钙,但目前尚无司维拉姆、碳酸镧或拟钙剂等妊娠期使用的相关研究。
伴大量蛋白尿和血清白蛋白<20 g/L 的患者应该在整个妊娠期间预防血栓,非严重肾病综合征伴其他血栓高危风险因素如肥胖、不动、膜性肾病或血管炎也要考虑抗凝,可选择皮下注射低分子肝素抗凝。预期分娩时通常停止预防血栓,但产后血栓风险尤其高,应尽可能继续抗凝至少持续至产后 6 周,具体参见美国胸科医师学会(American College of Chest Physicians)指南。
妊娠期降糖药物的使用参见美国糖尿病学会(American Diabetes Association, ADA)指南。
饮食管理
所有阶段的 CKD 及肾移植孕妇妊娠早期能量摄入为 35 kcal.kg-1.d-1(1 kcal = 4.184 kJ),孕中晚期在原基础上增加 300 kcal/d。CKD 1~3 期、4~5 期和透析孕妇蛋白质摄入分别为 0.8、0.6 和 1.2~1.3 g.kg-1.d-1,并在此基础上每天都再增加 10 g 蛋白质,可以根据理想体重每天补充酮酸 0.63 g /8~10 kg,这有利于减少 SGA 的出生。
3. 妊娠期随访
妊娠期需要肾脏科和产科医师合作,密切随访,以发现疾病活动及产科并发症(表 1)。肾脏科至少 4~6 周随访 1 次,根据肾脏病的严重程度和进展,可以增加监测频率。随访时需要监测血压(建议家庭自测血压并记录)、肾功能(包括 SCr、尿素和肌酐清除率)、血尿酸、24 h 尿蛋白定量、尿红细胞计数、中段尿培养(尤其是既往有肾盂肾炎的患者)、血糖(必要时糖耐量试验,尤其是服用激素或钙调蛋白抑制剂的孕妇)。记录基础尿酸、肝酶、血小板计数和尿蛋白水平,有助于妊娠后怀疑 PE 的鉴别诊断。对于系统性疾病如 LN 和血管炎等需每次随访监测相关的免疫学参数。基线及每 10~12 周,监测营养参数,包括铁、叶酸、维生素 D、维生素 B12、白蛋白和总蛋白。同时 CKD 孕妇应按产科医师要求定期于产科规律随访。
4. 分娩期管理
终止妊娠的指征
CKD 患者妊娠 32 周前孕妇或胎儿情况出现严重恶化,或妊娠 32 周后孕妇或胎儿情况出现不太严重的恶化均应终止妊娠。
此外,出现典型的 PE 或 HELLP 综合征,孕妇体情况逐渐恶化,包括严重且不能控制高血压,肾病综合征伴迅速增加的蛋白尿和(或)SCr 迅速增加。胎儿情况逐渐恶化,包括任何孕周的胎心率异常,≥ 32 周超声多普勒检查脐动脉舒张期血流缺失,孕晚期超过两周胎儿没有生长。出现上述情况,均应常规应用足疗程的地塞米松促胎肺成熟。
分娩发动前或分娩过程中胎儿出现异常情况,或引产过程中出现不利情况或引产失败均应以剖宫产结束分娩。
新生儿出生体重˂1500 g,孕周˂34 周,出生 5 min Apgar 评分˂7,需要插管的新生儿均应转入 NICU。
分娩方式
如病情稳定,无产科剖宫产指征,可考虑经阴道试产;但如果病情加重,估计不能短时间内阴道分娩时,可适当放宽剖宫产的指征。
5. 产后管理
CKD 患者的产后管理包括:
监测肾脏疾病活动情况
监测血压、尿检和肾功能等
对服用钙调蛋白抑制剂的患者,注意监测药物浓度
血栓高危患者,必要时继续预防血栓至产后 6 周
鼓励患者母乳喂养
给予情感支持,以防产后抑郁症
鼓励 CKD 患者使用最小剂量的妊娠期安全使用的药物,进行母乳喂养。仅很少剂量的泼尼松、硫唑嘌呤和他克莫司可分泌至母乳中,环孢素几乎在母乳中检测不到,因此这些药物哺乳期可继续使用。由于产后母体生理的变化,钙调蛋白抑制剂的药物浓度会升高,要尽早重新评估并调整剂量,避免对母体和可能对婴儿造成肾毒性。在疾病明显活动需要使用吗替麦考酚酯或环磷酰胺时,不能母乳喂养。大分子单克隆抗体不进入母乳,产后活动性肾炎可选择利妥昔单抗治疗。
关于降压药物,甲基多巴、拉贝洛尔和长效硝苯地平最常用。利尿剂的脱水作用可能阻碍泌乳,通常应避免。多个 RAS 抑制剂包括依那普利、卡托普利和喹那普利,都不能在母乳中检测到,产后应尽早开始使用 RAS 抑制剂降低蛋白尿。
患者经历了风险很大的妊娠,要注意产后情绪变化,以防产后抑郁症。
作者 | 黄湘华
封面图 | Vecteezy
欲知更多精彩内容,扫下方二维码关注「丁香智汇」