CA199 是医生非常熟悉的肿瘤标记物。在临床工作中,大家常常会有如下疑问:
为何正常人血中也可检测到 CA199?
血中 CA199 升高的原因是什么?
CA199 升高可能是哪些疾病?
发生恶性肿瘤时,哪些患者 CA199 会升高?
本文尝试回答这些问题。
「CA199」不可写成「CA1-99」
CA199 中的 CA 的含义是癌抗原(cancer antigen)或是碳水化合物抗原(carbohydrate antigen)。Carbohydrate 直译就是碳水化合物,不过医生更愿意称之为「糖」。在通行的中文文献中,我们也把 CA199 称为「糖链抗原」。「糖」后加上一个「链」,是什么原因呢?因为 CA199 是一种糖脂结构。
何谓糖脂?就是由糖分子末端的羟基(-OH)与脂质(神经酰胺)末端的羟基(-OH)通过半缩醛作用连接,形成「糖-O-脂」的化学结构。多数肿瘤标记物,如 CA125,是糖蛋白结构,它们与 CA199 的糖脂结构具有一个共同点,即都含有糖链。于是,为方便表述,将其统称为「糖链抗原」。
我们一般写为「CA19-9/CA19.9」或是「CA199」,而不可写成「CA1-99」。 如同 CA125 一样,CA199 的发现也是在 1970 年代末。通过杂交瘤技术,人们获得了一些可以与结直肠癌细胞结合的单克隆抗体,其中有一种被命名为 1116-NS-19-9,这些数字形式就是在制备单抗的过程中,经过多个不同的步骤和筛选而形成的。后来,将单抗 1116-NS-19-9 识别的抗原表位称为 CA19-91,2。
为何正常人血中也可检测到 CA199?
CA199 并非肿瘤特异性抗原,因为它在具有分泌作用的正常腺上皮细胞中广泛存在,几乎人体各个器官和组织的上皮中都发现存在 CA199 的表达(如下表)。因此,绝大部分正常人在血清中可以检测到 CA199。

但是,也有极少部分正常人(6~10%)在血清中几乎检测不到 CA199 的存在。而且,在那些可以检测到一定水平的人群中,个体差异也非常显著,这又是什么原因呢?
CA199 是一种含有唾液酸的酸性鞘糖脂(sphingolipid),称为神经节苷脂(ganglioside)。一般情况下是由 Lewis 抗原(包括 Le-a 和 Le-b)的前体物质在一种唾液酸转移酶和一种岩藻糖转移酶的共同作用下形成的。其合成的具体过程相对复杂,也无需细究,大致过程如下图。图示表明,正常人 CA199 的生理水平,因个体基因型不同而不同。
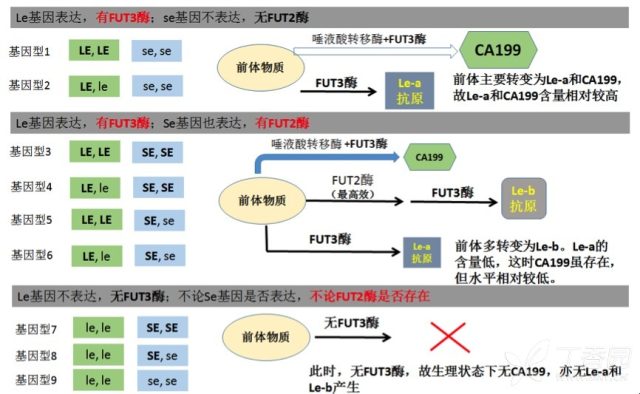
也就是说,并非所有个体都能产生相似水平的 CA199,其生理水平和遗传状态密切相关。不同的个体,因其基因型的不同,CA199 的生理水平也各不相同。
只有基因型 1 和 2 的个体,前体物质能合成较多量的 CA199,同时也能合成一定量的 Le-a 抗原,这种基因型称为 Le-a(+),Le-b(-)。这样个体的血清中,CA199 就能维持一定的水平。
而那些基因型为 3~6 的个体,虽然细胞也合成少量的 Le-a 抗原,但因同时存在高效的 FUT2 酶,可以将绝大部分前体转变为 Le-b 抗原。这样,前体物质相对不足,CA199 和 Le-a 产生相对较少,血清中 CA199 的水平则相对较低。这几种基因型也合称为 Le-a(-)Le-b(+)。
基因型为 le,le(双隐性)的个体呢,由于无 FUT3 酶,Le-a,Le-b 和 CA199 均无法产生。这部分个体血清里无法检测到 CA199 存在。这些人的基因型也称 Le-a(-)Le-b(-)3。
发生恶性肿瘤时,哪些人 CA199 会升高?
明确 CA199 生理水平在人群中具有多态性,对理解其在疾病中的临床意义至关重要!
多数情况下,只有上图中基因型 1~6 的个体,在相关部位发生恶性肿瘤时,才可能会有 CA199 升高,其中以基因型 1、2 的个体尤为明显;而基因型 7~9 的个体,即使存在相关的良恶性疾病,CA199 也不会升高,因为细胞中根本就缺乏合成 CA199 的前体物质。比如,在那些 Lewis 抗原阴性的个体中,即使胰腺癌(对 CA199 最敏感的恶性肿瘤)癌灶很大,期别很晚,CA199 仍无明显升高 4。
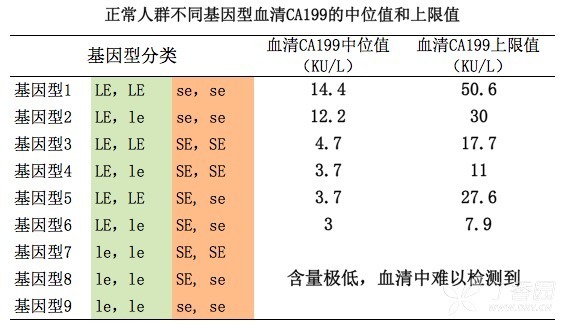
这个原则当然也存在例外:即基因型 7~9 的个体局部的恶性肿瘤出现了体细胞突变,相关的酶活性和功能出现了变化。比如,肿瘤细胞中 le 基因重新被激活合成了 FUT3 酶,这时可以大量合成 CA199,出现 CA199 升高。另一种极少见的情况是,肿瘤细胞因为种种原因积聚了某种多糖物质(为合成 CA199 的另一种前体),使得 CA199 的合成只需要加入一个唾液酸基团,而无需依赖于 FUT3 酶 5。
CA199 升高可能是哪些疾病?
由于 CA199 在机体多个正常组织中都存在,它成为了一种相当尴尬的肿瘤标志物:它升高时,尽管可能是恶性,但也很可能是良性,即诊断的特异性不足。
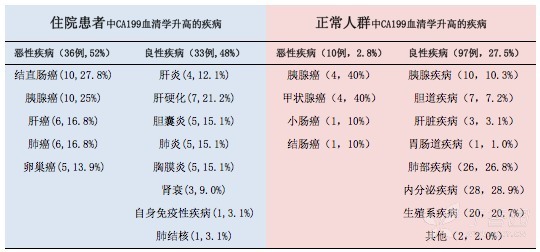
马来西亚一家医院对一年内,行 CA199 血清学检查的 650 例不同疾病的患者进行统计 6,发现血值升高者有 69 例。其中,36 例为恶性(52.2%),33 例为良性(47.8%)。(见下表)
正是因为如此,CA199 也很难对健康人群进行恶性肿瘤筛查。2010 年,韩国成均馆大学医院发表了一篇报告。他们用 3 年的时间,招募了 62976 名健康人进行前瞻性观察,发现 501 例(0.8%)出现无症状的 CA199 升高。对这 501 例人群进行长达一年的随访监测发现,仅有 10 例(2.8%)被诊断出恶性肿瘤,97 例(27.5%)罹患良性疾病(见下表)。其余的 246 例(69.7%)则无法查出任何器质性的疾病 7。
血中 CA199 为何会升高?
血中 CA199 升高的原因不外乎两点:1. 进入血循环的总量增多;2. 从血中代谢清除的减少。
1. 良性疾病
胰腺炎、肝炎、胆道炎症及梗阻性疾病就是 CA199 升高最常见的几种良性疾病。生理状态下,胆汁、胰液和肠道消化液中 CA199 就维持在较高水平,这些 CA199 都是由腺体上皮细胞分泌产生的。当发生炎症和梗阻时,管腔内的液体无法正常通畅地排出,且血管通透性增加,管腔内容物进入血管速度加剧,因此表现为血清 CA199 升高。而肾衰等疾病的 CA199 升高,则很可能与 CA199 无法及时地从循环中代谢清除有关系。
2. 恶性疾病
恶性疾病 CA199 升高的机制与良性疾病类似。只不过,在恶性疾病发生时,肿瘤缺氧导致的细胞增生更快,产生的 CA199 更多,细胞破坏更严重,释放入血的 CA199 总量就更大。此外,恶性疾病常常诱发新生血管形成,血管侵润破坏,进入循环中的 CA199 会更高(如下图 8)。
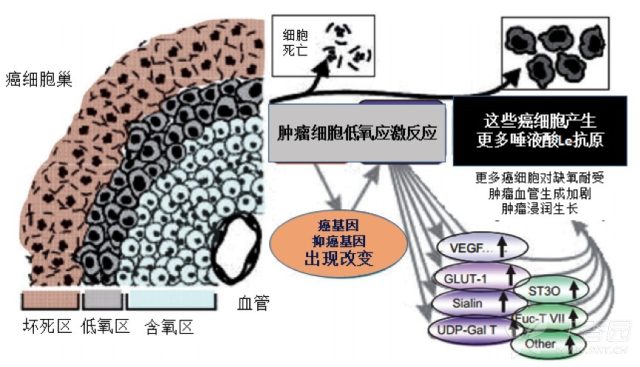
这就能解释,为什么多数情况下,CA199 水平在恶性疾病时会高于良性疾病。也能够解释,为什么 CA199 很难用于肿瘤的早期诊断。因为,在肿瘤发生的早期,CA199 释放的增加可能并不显著,血管的增生以及肿瘤对血管的破坏也并不明显,这样 CA199 在血中升高的程度也就非常有限 8。
CA199 在胰腺癌中有何价值?
关于 CA199 与胰腺癌,首先应该知晓下表的一些事实:CA199 对于胰腺癌的诊断随着临界值的提高,而特异性升高,敏感性下降。
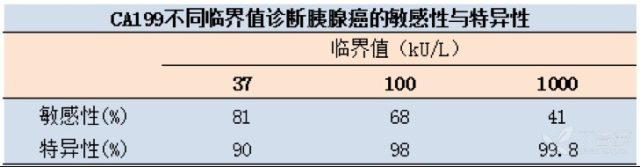
其次,即便 CA199 对胰腺癌具有如此良好的诊断价值,必须清楚的是 CA199 无法用于胰腺癌的早期筛查。因为,CA199 在胰腺癌发生早期很少升高:即使在胰腺癌病灶已能被 CT 发现但还 <3 cm 时,也仅有 50% 的患者出现血 CA199 升高。而且,CA199 也不无法预测胰腺癌的分期,因此无法用于评估胰腺癌患者能否手术切除。
CA199 在胰腺癌中的最大作用就是用于评估胰腺癌患者的术后复发以及对术后放疗化疗的疗效。因为,对于大多数患者来说,CA199 可以在影像学发现病灶之前升高。
为何 CA199 对于胰腺癌的价值更高?
多年来的研究表明,在胰腺癌中,CA199 可能不只起到一个肿瘤标志物的作用,它还在胰腺癌的发生发展中发挥着重要的生物学功能。不止一项研究揭示,CA199 和 Lewis-a 抗原在胰腺癌中起着促进肿瘤的作用 9,10,也有研究表明 Lewis-b 抗原过度表达对胰腺癌细胞的侵袭、粘附和转移具有抑制作用。
因此,研究人员就推测,很可能相对于基因型 3~6 的「Le-a(-),Le-b(+)」的个体,基因型 1、2 的「Le-a(+),Le-b(-)」型的个体更容易罹患胰腺癌 11。而且,根据不同的基因型制定 CA199 的 cut-off 值,对诊断胰腺癌具有更高的敏感性和特异性 12。可是,也有大规模的流行病学研究并不支持上述结论,认为胰腺癌患者的易感性与 Lewis 抗原的状态无关 13。
另外的原因可能是,胰腺癌细胞更容易出现某些代谢变异或缺陷,这种代谢改变促进了 CA199 和 Lewis-a 抗原的产生,从而让这部分癌细胞获得了生长、侵袭和转移优势,更加促进了胰腺癌的生长 8。
小结
总之,CA199 是一种肿瘤相关抗原,它在大部分正常人中存在,在极少部分正常人体内不存在。即便能在血中检出 CA199 的正常人群中,其生理水平也随基因型的不同而存在一定的差异。因此,目前 37kU/L 的参考值,只是在不考虑基因型时,对健康人群进行流行病学测定后计算出来的 95% 分位数值,日后很可能会对不同基因型的人群采用不同的参考值。
而且,CA199 对于诊断恶性肿瘤的特异性和敏感性均较低,这一特点决定了其难以应用于恶性肿瘤的筛查和早期诊断。此外,CA199 在胰腺癌中应用最广泛,在胰腺癌复发检测和术后放化疗疗效评估方面具有良好的临床价值,很可能 CA199 在胰腺恶性肿瘤的发生发展也起着重要的作用。
1. Magnani JL, Brockhaus M, Smith DF, et al. A monosialoganglioside is a monoclonal antibody-defined antigen of colon carcinoma. Science (New York, NY) 1981;212:55-6.
2. Magnani JL, Steplewski Z, Koprowski H, Ginsburg V. Identification of the gastrointestinal and pancreatic cancer-associated antigen detected by monoclonal antibody 19-9 in the sera of patients as a mucin. Cancer research 1983;43:5489-92.
3. Magnani JL. The discovery, biology, and drug development of sialyl Lea and sialyl Lex. Archives of biochemistry and biophysics 2004;426:122-31.
4. Vestergaard EM, Hein HO, Meyer H, et al. Reference values and biological variation for tumor marker CA 19-9 in serum for different Lewis and secretor genotypes and evaluation of secretor and Lewis genotyping in a Caucasian population. Clinical chemistry 1999;45:54-61.
5. Yazawa S, Asao T, Izawa H, Miyamoto Y, Matta KL. The presence of CA19-9 in serum and saliva from Lewis blood-group negative cancer patients. Japanese journal of cancer research : Gann 1988;79:538-43.
6. Pavai S, Yap SF. The clinical significance of elevated levels of serum CA 19-9. The Medical journal of Malaysia 2003;58:667-72.
7. Kim BJ, Lee KT, Moon TG, et al. How do we interpret an elevated carbohydrate antigen 19-9 level in asymptomatic subjects? Digestive and liver disease : official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver 2009;41:364-9.
8. Galli C, Basso D, Plebani M. CA 19-9: handle with care. Clinical chemistry and laboratory medicine 2013;51:1369-83.
9. Iwai K, Ishikura H, Kaji M, et al. Importance of E-selectin (ELAM-1) and sialyl Lewis(a) in the adhesion of pancreatic carcinoma cells to activated endothelium. International journal of cancer 1993;54:972-7.
10. Kijima H, Kashiwagi H, Dowaki S, et al. Stromal sialyl Le(a) expression is correlated with vascular invasion of human gallbladder adenocarcinoma. International journal of oncology 2000;17:55-60.
11. Koprowski H, Brockhaus M, Blaszczyk M, Magnani J, Steplewski Z, Ginsburg V. Lewis blood-type may affect the incidence of gastrointestinal cancer. Lancet (London, England) 1982;1:1332-3.
12. Luo G, Guo M, Jin K, et al. Optimize CA19-9 in detecting pancreatic cancer by Lewis and Secretor genotyping. Pancreatology : official journal of the International Association of Pancreatology (IAP) [et al] 2016;16:1057-62.
13. Tempero MA, Uchida E, Takasaki H, Burnett DA, Steplewski Z, Pour PM. Relationship of carbohydrate antigen 19-9 and Lewis antigens in pancreatic cancer. Cancer research 1987;47:5501-3.
本文作者:大连医科大学附属第一医院妇产科 肖祯
