2017 年,欧洲肿瘤内科学会 (ESMO) 发布了宫颈癌的诊断,治疗和随访指南,本文结合 2015 年 FIGO 指南对该指南的相关内容进行梳理总结。
宫颈癌的主要病因是高危型 HPV 的持续感染,在 99% 的宫颈癌中都能检出 HPV,尤其是高危型的 HPV16/18。
截止目前,临床上可用的宫颈癌疫苗共有 3 种,2 价疫苗、4 价疫苗和 9 价疫苗。所有疫苗均能覆盖 HPV 16/18。4 价疫苗能覆盖 HPV 16/18/6/11。9 价疫苗能覆盖 HPV16/18/6/11/31/33/45/52/58。3 种疫苗均能有效预防相关 HPV 感染引起的宫颈、阴道、外阴及肛门病变。
宫颈细胞学检查作为宫颈癌筛查的主要手段,但其缺点在于其敏感度较差(约 50%)及标本的不合格率较高。因此,近年来 HPV DNA 检测逐步取代原有的宫颈癌筛查手段,其筛查 CIN2+病变的敏感度明显高于细胞学检查。而且基于 HPV 的宫颈癌筛查初始年龄可推迟到 30 岁。
宫颈癌的初始预防推荐使用高效价 HPV 疫苗,次级预防推荐联合 HPV DNA 检测以提高细胞学检查的敏感性。
临床表现
早期宫颈癌多无明显临床症状,局部进展后可表现为异常阴道出血(多为接触性出血),阴道流液,盆腔痛及性交困难,晚期根据癌灶累及范围出现不同的继发性症状,如尿急、尿频、便秘、下肢肿痛等;肿瘤压迫或累及输尿管时,可引起输尿管梗、肾盂积水等;晚期可有贫血、恶病质等全身衰竭症状。
病理类型
宫颈癌大体上可分为外生型、内生型、溃疡型、颈管型等,高危型 HPV 持续性感染在其发病过程中发挥重要作用,其中 HPV16/18 感染占所有宫颈癌患者中的至少 2/3,其他高危型 HPV 还有 HPV 31/33/35/45/52/58。
WHO 定义了宫颈上皮性肿瘤的 3 种病理类型:鳞癌,腺癌和其他如腺鳞癌、神经内分泌癌及未分化癌等。具体 WHO 宫颈癌组织病理学分类表见表 1。

子宫颈癌分期和风险评估
1.分期
子宫颈癌采用国际妇产科联盟(FIGO,2009)的临床分期标准和 TNM 分期。临床分期应该在治疗前进行,治疗后不再更改。对于手术的病例,病理医生可以根据切除标本准确地描述疾病的范围。这些病理发现虽然不能改变临床分期,但能以 TNM 分期的形式记录下来。
实际上,FIGO 临床分期和 TNM 分期在描述疾病的解剖学累及范围是一致的。临床分期本质上是用于选择治疗方案,病理分期则用于估计预后。
FIGO 分期根据肿瘤浸润深度、大小,是否有阴道或宫旁受累,是否有膀胱直肠受累及是否发生远处转移进行分期,具体分期见表 2。

为了准确进行临床分期,必须对患者进行全面的盆腔检查,必要时可在麻醉下进行检查。
ⅠA1 期和ⅠA2 期的诊断可通过锥切标本的显微镜下测量评估浸润深度及宽度来确定。对于肉眼可见病灶的病例,必须行胸片检查,必要时可行肾盂造影,CT、MRI 检查。CT 可用于检测有无淋巴转移,MRI 则能更加精确检测肿瘤大小,基质浸润深度,有无宫旁、阴道累及等。PET-CT 可用于检测有无远处转移,具有很高的敏感度和特异性。对于局部晚期宫颈癌,是否需治疗前行腹主动脉旁淋巴结活检以辅助制定治疗方案及评估预后,尚有争议。
2.肿瘤风险评估
包括肿瘤大小、分期、浸润深度,是否淋巴血管间隙浸润,组织学分型等。
其中主要预后影响因素为有无淋巴结转移及淋巴结累及数目。组织学类型是否为独立预后影响因素尚有争议,虽然一些研究发现鳞癌与腺癌在远期生存率方面并无差异,但多数研究表明腺癌的 5 年生存率更差。宫颈小细胞神经内分泌肿瘤发病率极低,仅占所有浸润性宫颈癌的 2%,但容易远处转移,预后较差。患者可表现为全身症状,如体重减轻及副肿瘤综合征,如抗利尿激素分泌异常综合征、Cushing 综合征、高血钙等。常累及的器官为肝脏、肾上腺、骨、骨髓、脑。
不同分期宫颈癌的处理
1. 初始治疗
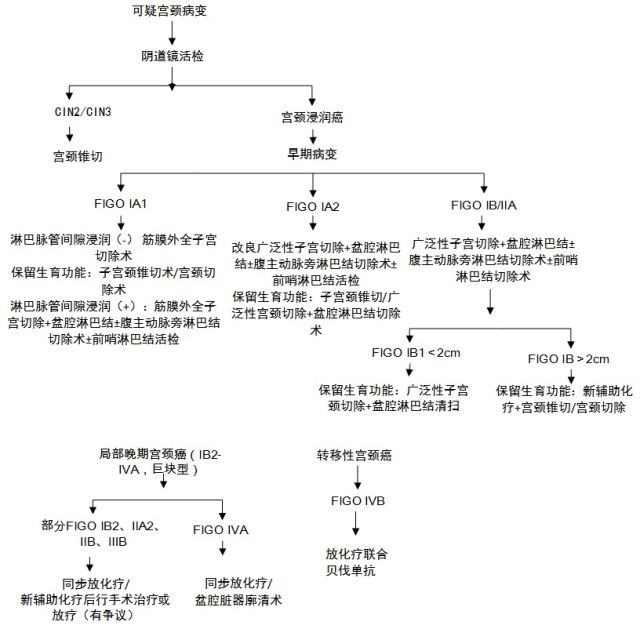
IA1 期无淋巴脉管浸润推荐行子宫颈锥切或子宫颈切除术以保留生育功能。
如患者无生育要求,可行筋膜外全子宫切除术。
IA1 期伴淋巴脉管浸润推荐行筋膜外全子宫切除术,并与患者及家属商议是否行盆腔淋巴结切除术及前哨淋巴结活检术。
IA2 期推荐行改良广泛性子宫切除术+盆腔淋巴结切除术。
要求保留生育功能者,可选择:宫颈锥切+腹腔镜下淋巴结切除术或经腹、经阴道或经腹腔镜广泛性宫颈切除术+盆腔淋巴结切除术。
IB-ⅣA 期
IB,ⅡA 期治疗应结合患者具体情况及客观条件行个体化治疗。采用手术加或不加辅助治疗与初始就采用同步放化疗的疗效相当,选择手术或同步放化疗取决于有无放疗设备、肿瘤及患者相关因素。如果手术,推荐行广泛子宫切除术+双侧盆腔淋巴结切除术±腹主动脉旁淋巴结活检术。
ⅣA 期患者若未侵犯到盆壁,尤其是合并膀胱阴道瘘或直肠阴道瘘者,初始治疗可考虑行盆腔脏器廓清术。部分 IB2、ⅡA2、ⅡB、ⅢB 和ⅣA 期宫颈癌(巨块型 IB2-ⅣA 期宫颈癌,即局部晚期宫颈癌)患者推荐行同步放化疗。目前最常用的同步放化疗方案为在外照射过程中,每周 1 次的顺铂(每周 40 mg/m2 配合适当的水化)连用 5~6 个周期。对于不能接受铂类化疗的患者,以 5-FU 为基础的方案是可供替代的选择。
2.术后辅助治疗
对于行手术治疗的患者,术后应对病理标本进行复发危险性的组织病理学评估:
评估内容包括肿瘤直径、宫颈间质浸润深度、肿瘤分化、有无淋巴脉管间隙浸润、切缘阴/阳性、有无宫旁受累、阴道断段是否受累、是否淋巴结受累。
根据复发的危险性分为中危和高危。

3.转移或复发型宫颈癌的治疗
对于 PS<2,且无化疗禁忌的患者,在充分考虑患者生存期的前提下,建议行姑息性化疗缓解症状,改善生活治疗。
目前,顺铂仍然是治疗远处转移性宫颈癌的标准化疗药物。
最近的证据支持以顺铂类为基础的双药(顺铂+紫杉醇/拓扑替康)、三药(TIP 方案,紫杉醇+异环磷酰胺+顺铂)联合化疗,其反应率及无进展生存期均优于顺铂单药。
对于不适于应用顺铂化疗的患者,卡铂联合紫杉醇方案可作为其替代选择。
鉴于肿瘤血管生成在肿瘤进展中发挥的重要作用,因此对抗血管生成药物贝伐单抗联合化疗在转移或复发性宫颈癌中的治疗效果进行评估,发现化疗方案中加入贝伐单抗可显著延长患者生存时间。
因此,建议紫杉醇联合顺铂+贝伐单抗方案可作为转移或复发型宫颈癌的一线治疗方案。如一线治疗失败后,尚无有效的二线治疗方案。
放疗作为局部治疗手段主要针对远处转移灶少,仅有盆腔、腹主动脉旁、锁骨上淋巴结转移,并有相关转移症状的患者。通常可以用姑息性放疗来缓解症状,考虑到转移性宫颈癌患者的预期生命较短,姑息性放疗通常采用短期内大剂量放疗而不是常规的放疗模式。
4. 宫颈癌初始治疗后局部复发的治疗
宫颈癌初始治疗(手术/放疗)后局部复发的治疗包括根治性放疗或盆腔脏器廓除术。
局部复发后主要预后因素包括无瘤间歇期的时间、复发部位(中心性盆腔复发,是否累及盆壁)及复发病灶的大小。
对于孤立的中心性盆腔复发且未累及到盆壁,无瘤间歇期长,复发病灶直径小于 3 cm 的患者,预后较好。
综上,对于分期较早,尚可行手术治疗的建议行手术治疗+术后同步放化疗/化疗;对于局部晚期宫颈癌已无法手术切除且未见远处转移的,建议行足疗程同步放化疗;对于已经远处转移的,可行姑息性放化疗。

前哨淋巴结切除:
目前对于是否需行前哨淋巴结切除尚无定论,但目前临床证据建议 FIGO I 期,肿瘤直径 ≤ 4 cm 可行前哨淋巴结切除,同时建议行双侧前哨淋巴结活检。
新辅助化疗(NACT)
理论上来讲,采用新辅助化疗(NACT)可以缩小肿瘤体积从而有利于根治性切除,同时可以清除转移淋巴结和宫旁病灶,因此减少了术后辅助治疗的高危因素。
但目前关于新辅助化疗的效果尚缺乏足够的临床证据。
目前证据表明对于局部晚期宫颈癌(LACC,一组具有不良预后因素的高危宫颈癌 IB2-ⅣA,局部肿瘤直径 ≥ 4 cm 的巨块型宫颈癌)、淋巴结、宫旁受累的患者,NACT+手术治疗可能优于仅行手术治疗,降低术后行进一步放疗的可能性。
新辅助化疗与放疗
目前关于放疗前行新辅助化疗是否能延迟生存期尚存在争议。
6. 随访
治疗后 2 年内每 3~6 个月复查 1 次,3~5 年内 6~12 个月复查 1 次,第 6 年开始每年复查 1 次。随访内容应包括完整的体格检查,盆腔检查、详细询问病史等,必要时行 CT、MRI 或 PET-CT 等影像学检查。
参考文献
[1]. C. Marth et al., Cancer, Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 28 (Supplement 4): iv72–iv83, 2017
[2]. Denny, L. and M. Quinn, FIGO Cancer Report 2015. Int J Gynaecol Obstet, 2015. 131 Suppl 2: p. S75.
[3]. 谢幸等, 妇产科学第八版,p.304-209.
